Ботанчик
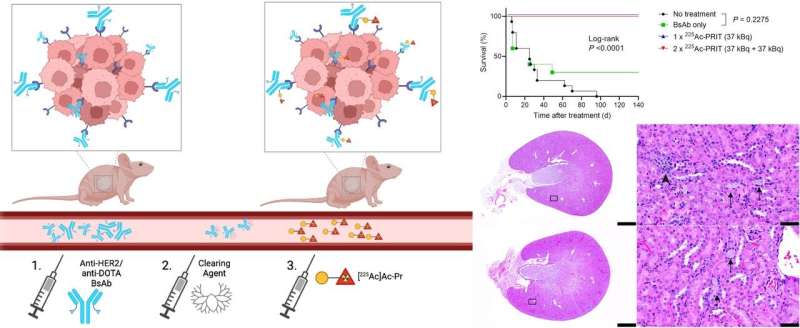
![Graphical Abstract: Schematic representation of 3-step HER2-targeted 225Ac-PRIT, 225Ac-PRIT treatment of BT-474 human breast cancer cell derived xenograft, and representative histologic images of kidneys stained with hematoxylin and eosin, taken from treated mice at 175 days (top: untreated control; bottom: 2 x 225Ac-PRIT [37 kBq + 37 kBq]). Credit: S. Rinne et al. Weil Cornell Medicine, New York, NY.](/wp-content/uploads/2025/11/her2-targeted-radioimmunotherapy-regimen-achieves-complete-and-durable-response-in-breast-cancer-model-7a1f516.jpg)
Согласно новому исследованию, опубликованному в ноябрьском номере журнала ядерной медицины (Journal of Nuclear Medicine), новый подход к радиоиммунотерапии потенциально может вылечить рак молочной железы, положительный на рецептор 2 эпидермального фактора роста человека (HER2). Этот режим, предусматривающий предварительную обработку опухоли перед проведением целенаправленной альфа-радиоиммунотерапии, привел к стойким основным результатам, включая гистологическое излечение, с минимальной токсичностью, что открыло путь к более безопасному и эффективному лечению больных раком молочной железы.
Распространенный метастатический рак молочной железы имеет неблагоприятный прогноз, особенно при высокоагрессивных HER2-позитивных подтипах. HER2 - это онкоген, избыточная экспрессия которого наблюдается в 15-20% случаев рака молочной железы, и который является клинически доказанной терапевтической мишенью. Хотя современные методы лечения, нацеленные на HER2, улучшают результаты, проблемы остаются из-за побочных эффектов, связанных с лечением, и устойчивости опухоли к лечению.
"Предыдущие исследования показали, что радиоиммунотерапия, направленная на HER2, радионуклидом 225Ac, излучающим α-частицы, была эффективной, но небезопасной, поскольку альфа-частицы задерживались в организме, что приводило к высокой токсичности", - отметила Сара Чил, доктор философии, доцент медицинского факультета Weill Cornell в Нью-Йорке. "В нашем исследовании мы использовали метод преднацеленной радиоиммунотерапии (PRIT) для непосредственного лечения опухоли и предотвращения поглощения мощных альфа-частиц здоровыми тканями".
Метод радиоиммунотерапии состоял из трехэтапного внутривенного введения: сначала биспецифические антитела против HER2/анти-DOTA, затем очищающее средство и, наконец, радиоиммунотерапия 225Ac-Pr. Исследователи начали с тестирования влияния дозировки 225Ac-Pr во время PRIT на эффективность воздействия на опухоль и биораспределение тканей на модели ксенотрансплантата рака молочной железы BT-474.
Затем режим лечения был оценен на мышах, которым был имплантирован ксенотрансплантат BT-474 или ксенотрансплантат, полученный от пациента. Мышей лечили одним или двумя циклами 225Ac-PRIT с интервалом в одну неделю. На модели BT-474 также было проведено исследование по увеличению дозы, чтобы установить нефротоксическую поглощенную дозу облучения.
В модели BT-474 у 100% мышей был достигнут полный ответ, а у 85% - гистологическое излечение. Одноцикловое и двухцикловое лечение было одинаково эффективным. Переносимость лечения была хорошей, хронической радиационной токсичности зафиксировано не было. В модели ксенотрансплантата, полученного от пациента, однократная обработка 225Ac-PRIT привела к 60%-ному полному ответу и увеличению продолжительности жизни по сравнению с отсутствием лечения. Наконец, исследователи определили дозу в режиме 225Ac-PRIT, при которой вызывалась тяжелая хроническая нефротоксичность.
"Это исследование иллюстрирует лечебный потенциал 225Ac-PRIT в качестве средства для лечения высокоагрессивных подтипов HER2-позитивного рака молочной железы", - сказал Най Конг Чунг, доктор медицинских наук, сотрудник и лечащий врач отделения детской онкологии Мемориального онкологического центра Слоана Кеттеринга в Нью-Йорке. - В случае успешного внедрения в клинику терапия 225Ac, направленная на HER2, может предложить новые варианты лечения рака молочной железы и других солидных опухолей, экспрессирующих HER2".
Дополнительная информация: Sara S. Rinne и соавт., 225Ac α-Предварительно нацеленная радиоиммунотерапия рака молочной железы, экспрессирующего рецептор 2 эпидермального фактора роста человека, Журнал ядерной медицины (2025). DOI: 10.2967/номер журнала:125.269601
Информация о журнале: Journal of Nuclear Medicine
Новости
источник
Комментариев нет:
Отправить комментарий